 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知0.1mol·L-1的醋酸溶液中存在电离平衡:CH3COOH⇌CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)的值增大,可以采取的措施是()①加少量烧碱溶液②升高温度③加少量冰醋酸④加水(分值:)
A.①②
B.①③
C.②④
D.③④
 答案
答案
C、②④
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.①②
B.①③
C.②④
D.③④
 答案
答案
C、②④
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“已知0.1mol·L-1的醋酸溶液中存在电离平衡:CH3CO…”相关的问题
更多“已知0.1mol·L-1的醋酸溶液中存在电离平衡:CH3CO…”相关的问题
A.在pH=12的溶液中,K+、Cl-、HCO3-、Na+可以大量共存
B.在pH=0的溶液中,Na+、NO3-、SO3(2-)、K+可以大量共存
C.由0.1mol·L-1一元碱BOH溶液的pH=10,可推知BOH溶液中存在BOH=B++OH-
D.由0.1mol·L-1一元酸HA溶液的pH=3,可知NaA溶液中存在A-+H2O⇌HA+OH-
A.物质的量浓度相同时,各溶液的pH关系为pH(Na2Y)>pH(NaX)>pH(NaHY)
B.mol·L-1HX溶液与bmol·L-1NaOH溶液等体积混合,所得溶液中存在c(Na+)>c(X-),则不一定a<b
C.在HX溶液中滴入Na2Y溶液,反应2HX+Y2-===2X-+H2Y成立
D.若0.1mol·L-1NaHY溶液呈酸性,则其水解能力小于电离能力
用c(CHL)=0.1mol•L-1HCl溶液滴定c(NH3)=0.1mol•L-1氨水溶液化学计量点时溶液的pH值为()。
A.等于7.0;
B.小于7.0;
C.等于8.0;
D.大于7.0
A.醋酸能使石蕊试液变红
B.醋酸能被氨水中和
C.醋酸钠溶液的pH>7
D.常温下,0.1mol/L CH3COOH中c(H+)为1.32×10-3mol/L
用c(HCI)=0.1mol?L-1HCI溶液滴定c(NH3)=0.1mol?L-1氨水溶液化学计量点时溶液的pH值为()。
A.等于7.0
B.小于7.0
C.等于8.0
D.大于7.0
A.增大c(CH3COOH),b增大
B.加水稀释,b减小
C.的大小只与温度有关
D.以上说法均不对
曾在南充求学和工作过的青年学者孙旭平及其领衔团队,近日成功利用Mo2N纳米催化剂0.1mol·L-1盐酸溶液中进行电催化固氮,装置如图所示,在一定电压下具有较高的产氨速率。下列判断错误的是()。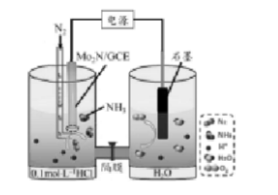
A.Mo2N/GCE电极为阴极
B.溶液中H+通过隔膜向MoN/GCE电极区迁移
C.Mo2N/GCE电极区反应式为N2+6H++6e-=2NH3
D.为提高溶液的导电性,可在石墨电极区加入适量的盐酸
随着工业的迅速发展,产生的废水对水体的污染也日趋严重。通过控制溶液的pH对工业废水中的金属离子进行别离是实际工作中经常使用的方法。下表是常温下金属氢氧化物的Ksp(沉淀溶解平衡常数)和金属离子在某浓度下开始沉淀所需的pH(表中浓度为相应pH时溶液中有关金属离子产生沉淀的最小浓度;当溶液中金属离子浓度小于10-5mol•L-1时通常认为该离子沉淀完全)。 问题一、某厂排出的废水中含有Cu2+和Fe3+,测得其浓度均小于0.1mol•L-l。为除去其中的Fe3+,回收铜,需控制的pH范围是()。
问题一、某厂排出的废水中含有Cu2+和Fe3+,测得其浓度均小于0.1mol•L-l。为除去其中的Fe3+,回收铜,需控制的pH范围是()。
问题二、为了处理含有Cr2O72-酸性溶液的工业废水,采用如下方法:向废水中加人适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准
①Cr2O72-转变为Cr3+的离子方程式为()。
②pH对废水中Cr2072-去除率的影响如右图。你认为电解过程中溶液的pH取值在()范围内对降低废水中的铬含量最有利,请说明理由:()。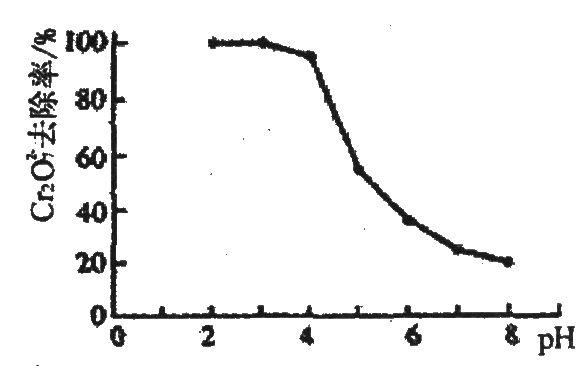
问题三、沉淀转化在生产中也有重要应用。例如,用Na2C03溶液可以将锅炉水垢中的CaS04转化为较疏松而易清除的CaC03,该沉淀转化到达平衡时,其平衡常数K=()。(已知Ksp(CaS04)=9.1x10-6,Ksp(CaC03)=2.8x10-9)
A.等体积混合浓度均为0.2 mol·L-1的AgNO3溶液和CH3COONa溶液一定产生CH3COOAg沉淀
B.将0.001 mol·L-1的AgNO3溶液滴入0.001 mol·L-1的KCl和0.001 mol·L-1的K2CrO4溶液中先产生Ag2CrO4沉淀
C.在Mg2+为0.121 mol·L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH至少要控制在9以上
D.向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)变大
A.4.75
B.6.25
C.7.00
D.9.25