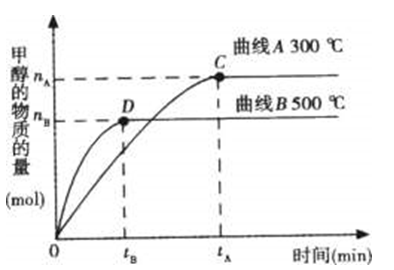
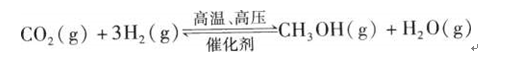题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知25℃时有关弱酸的电离平衡常数K1(H2Y)>K(HX)>K2(H2Y),则下列叙述不正确的是()
A.物质的量浓度相同时,各溶液的pH关系为pH(Na2Y)>pH(NaX)>pH(NaHY)
B.mol·L-1HX溶液与bmol·L-1NaOH溶液等体积混合,所得溶液中存在c(Na+)>c(X-),则不一定a<b
C.在HX溶液中滴入Na2Y溶液,反应2HX+Y2-===2X-+H2Y成立
D.若0.1mol·L-1NaHY溶液呈酸性,则其水解能力小于电离能力
 答案
答案
C、在HX溶液中滴入Na2Y溶液,反应2HX+Y2-===2X-+H2Y成立
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案

 更多“已知25℃时有关弱酸的电离平衡常数K1(H2Y)>K(HX)…”相关的问题
更多“已知25℃时有关弱酸的电离平衡常数K1(H2Y)>K(HX)…”相关的问题
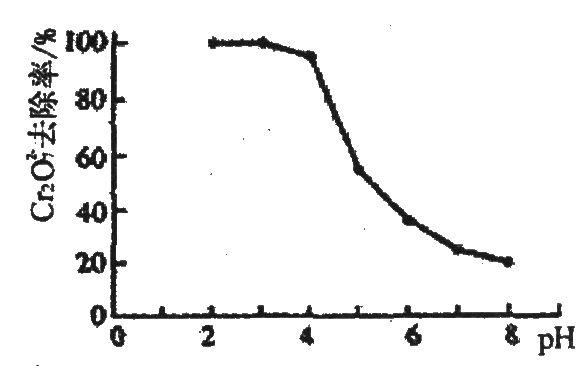
 问题一、某厂排出的废水中含有Cu2+和Fe3+,测得其浓度均小于0.1mol•L-l。为除去其中的Fe3+,回收铜,需控制的pH范围是()。
问题一、某厂排出的废水中含有Cu2+和Fe3+,测得其浓度均小于0.1mol•L-l。为除去其中的Fe3+,回收铜,需控制的pH范围是()。