 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
滴定分析法是根据某一反应,将一已知准确()的试剂溶液滴加到待测溶液中,直到所加试剂恰好与待测组分按()反应为止,根据试剂溶液的()和消耗()计算待测组分的含量。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“滴定分析法是根据某一反应,将一已知准确()的试剂溶液滴加到待…”相关的问题
更多“滴定分析法是根据某一反应,将一已知准确()的试剂溶液滴加到待…”相关的问题
工业上以锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下: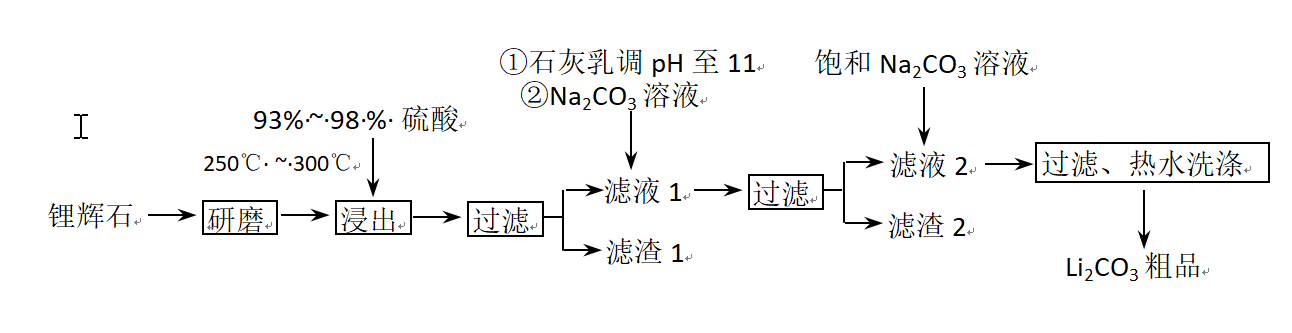 已知:①
已知:①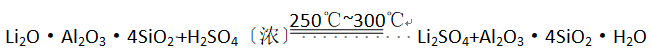 ②某些物质的溶解度(S)如下表所示
②某些物质的溶解度(S)如下表所示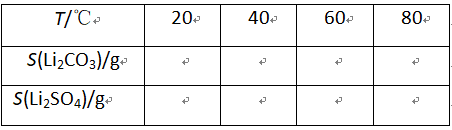
问题一、从滤渣1中别离出Al2O3的部分流程如以下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤Ⅱ中反应的离子方程式是()。
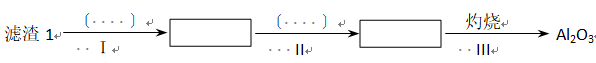
问题二、已知滤渣2的主要成分有Mg(OH)2和CaCO3向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)()
问题三、向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是()
问题四、工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下()
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3
①a中,阳极的电极反应式是()。
②b中,生成Li2CO3反应的化学方程式是()。
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeCO3固体
Ⅴ.煅烧FeCO3,得到Fe2O3固体
已知:NH4HCO3在热水中分解
问题一、Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是()
问题二、Ⅱ中,需加一定量硫酸。运用化学平衡原理简述硫酸的作用()
问题三、Ⅲ中,生成FeCO3的离子方程式是()。假设FeCO3浊液长时间暴露在空气中,会有部分固体外表变为红褐色,该变化的化学方程式是()
问题四、Ⅳ中,通过检验来判断沉淀是否洗涤干净。检验的操作是()。
问题五、已知煅烧FeCO3的化学方程式是 。现煅烧464.0kg的FeCO3,得到316.8kg产品。假设产品中杂质只有FeO,则该产品中Fe2O3的质量是()kg。(摩尔质量/g·mol-1:FeCO3116Fe2O3160FeO72)
。现煅烧464.0kg的FeCO3,得到316.8kg产品。假设产品中杂质只有FeO,则该产品中Fe2O3的质量是()kg。(摩尔质量/g·mol-1:FeCO3116Fe2O3160FeO72)
聚合氯化铝是一种新型、高效絮凝剂和净水剂,其单体是液态的碱式氯化铝(Al2(OH)nCl6-n)。本实验采用铝盐溶液水解絮凝法制备碱式氯化铝。其制备原料为分布广、价格廉的高岭土,化学组成为:Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量杂质和水分。已知氧化铝有多种不同的结构,化学性质也有差异,且一定条件下可相互转化;高岭土中的氧化铝难溶于酸。制备碱式氯化铝的实验流程如下
 根据流程图答复以下问题:
根据流程图答复以下问题:
问题一、“煅烧”的目的是()。
问题二、配制质量分数15%的盐酸需要200mL30%的浓盐酸(密度约为1.15g·cm-3)和()g蒸馏水,配制用到的仪器有烧杯、玻璃棒、()。
问题三、“溶解”过程中发生反应的离子方程式为()。
问题四、加少量铝粉的主要作用是()。
问题五、“调节溶液pH在~4.5”的过程中,除添加必要的试剂,还需借助的实验用品是();“蒸发浓缩”需保持温度在90~100℃,控制温度的实验方法是()。
工业上以氨气为原料制备硝酸的过程如下: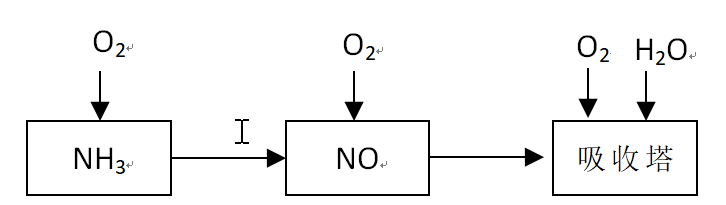 某课外小组模拟上述部分过程设计了如下实验装置制备硝酸(所有橡胶制品均已被保护)。
某课外小组模拟上述部分过程设计了如下实验装置制备硝酸(所有橡胶制品均已被保护)。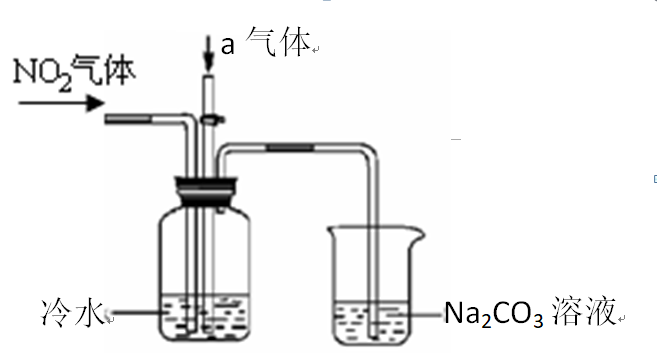
问题一、工业上用氨气制取NO的化学方程式是()。
问题二、连接好该装置后,首先进行的操作是()。
问题三、通入a气体的目的是()。
问题四、盛有Na2CO3溶液的烧杯为尾气处理装置,该装置中反应的化学反应方程式是2NO2+Na2CO3==NaNO2+()+()
问题五、已知:温度低于21.15℃时,NO2几乎全部转变为N2O4.工业上可用N2O4与水反应来提高硝酸产率。N2O4与a气体在冷水中生成硝酸的化学方程式是()。
问题六、一定条件下,某密闭容器中N2O4和NO2的混合气体到达平衡时,c(NO2)=0.50mol/L、c(N2O4)=0.125mol/L。则2NO2(g) N2O4(g)的平衡常数K=()。假设NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为()。
N2O4(g)的平衡常数K=()。假设NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为()。
某氮肥厂氨氮废水中的氮元素多以NH和NH3·H2O的形式存在,该废水的处理流程如下:![]()
问题一、过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收。
①用离子方程式表示加NaOH溶液的作用:()。
②用化学平衡原理解释通空气的目的:()。
问题二、过程Ⅱ:在微生物作用的条件下,NH经过两步反应被氧化成NO。两步反应的能量变化示意图如下:
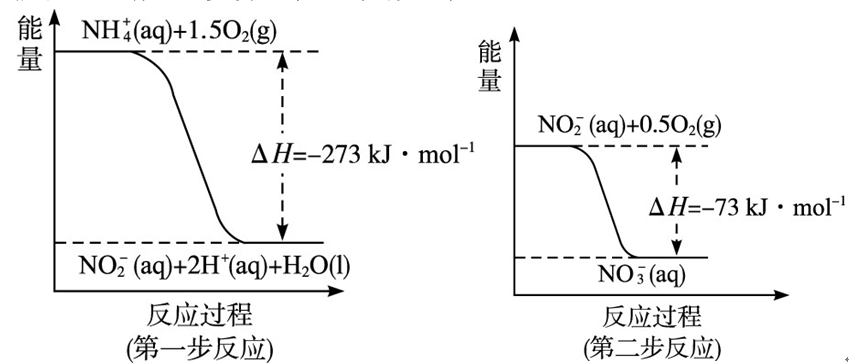
①第一步反应是()反应(选填“放热”或“吸热”),判断依据是()。
②1molNH(aq)全部氧化成NO(aq)的热化学方程式是()。
问题三、过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3复原成N2。假设该反应消耗32gCH3OH转移6mol电子,则参加反应的复原剂和氧化剂的物质的量之比是()。